Il trapianto
Con il termine trapianto si intende la sostituzione, in un soggetto “ricevente”, di un organo e/o tessuto non funzionante con un altro, proveniente da un soggetto “donatore”. Gli organi e/o i tessuti che vengono più comunemente trapiantati sono reni, cuore, fegato, polmoni, pancreas, intestino, cornea, cute, osso, midollo osseo, valvole cardiache. In particolare, per alcuni di questi, la donazione può essere fatta anche da un soggetto vivente. Per legge, invece, è vietato il prelievo di gonadi e del cervello, nonché la manipolazione genetica degli embrioni anche ai fini del trapianto.
Vi sono differenti tipi di trapianto:
- autotrapianto: quando donatore e ricevente sono lo stesso individuo;
- allotrapianto: quando donatore e ricevente sono due individui differenti, ma appartenenti alla stessa specie;
- isotrapianto: quando donatore e ricevente sono due individui geneticamente identici (gemelli monozigoti);
- xenotrapianto: quando donatore e ricevente appartengono a specie differente (come nel caso del trapianto di valvole cardiache).
Il problema principale del trapianto è correlato alla scelta del donatore. Non solo vi è poca disponibilità di donatori, ma questi, spesso, non sono compatibili con il ricevente. Quest’ultima condizione è molto importante, perché, in assenza di compatibilità con il ricevente, è molto alto il rischio di rigetto d’organo.
Il rigetto
Per prevenire il rigetto, prima del trapianto, sia donatore che ricevente si sottopongono ad un’indagine genetica che prende il nome di tipizzazione. Con questa analisi, si individuano gli antigeni del complesso maggiore di istocompatibilità (MHC) presenti a livello delle cellule dell’organo e/o tessuto da trapiantare. Maggiore è la similarità di questi antigeni tra donatore e ricevente, migliore sarà la riuscita del trapianto e minori saranno le probabilità di rigetto.
Il rigetto si verifica nel momento in cui l’organismo ricevente – o meglio, il suo sistema immunitario – riconosce come estraneo l’organo e/o il tessuto trapiantato. La conseguenza di questo è una reazione che porta ad un danno all’organo e/o al tessuto trapiantato, che deve, di conseguenza, essere rimosso.
Il rigetto può essere di tre tipi:
– iperacuto: si manifesta da qualche minuto a qualche ora dal trapianto. Si manifesta principalmente nel caso di xenotrapianto o nel caso di pre-sensibilizzazione del ricevente (presenza nel ricevente di anticorpi pre-formati contro gli antigeni del donatore);
– acuto: si manifesta da qualche giorno ad un anno dal trapianto;
– cronico: si manifesta a distanza di mesi e/o anni dal trapianto.
Quest’ultimo è sicuramente quello più difficile da gestire, perché richiede una continua terapia con farmaci immunosoppressori. Questi, però, hanno degli effetti collaterali gravi e, spesso, non riescono ad evitare il rigetto a lungo termine.
Memoria immunologica
Essendo il sistema immunitario implicato nel meccanismo di rigetto, potrebbe essere importante anche la memoria immunologica. Questa, infatti, da un lato protegge l’ospite dalle infezioni, dall’altro potrebbe essere una barriera contro la sopravvivenza a lungo termine dell’organo e/o del tessuto trapiantato.
Si è sempre pensato che la memoria fosse una caratteristica tipica delle cellule della risposta immunitaria adattativa (linfociti T e linfociti B). In realtà si è visto che questa è presente anche nella risposta immunitaria innata, sia a livello dei linfociti NK sia a livello di monociti e macrofagi. In particolare, questi ultimi presentano una memoria immunologica simile a quella tipica della risposta immunitaria adattativa, poiché, nel momento in cui incontrano nuovamente uno stimolo, danno una reazione potenziata.
Uno studio, condotto dai ricercatori della University of Pittsburgh School of Medicine e dello Houston Methodist Hospital, ha cercato di capire il meccanismo alla base della memoria immunologica nella risposta immunitaria innata e il suo ruolo nel trapianto.
Memoria immunologica e trapianto
Per studiare lo sviluppo della memoria immunologica, da parte di monociti e macrofagi, i ricercatori hanno utilizzato dei modelli murini. Si tratta di modelli murini geneticamente modificati, poiché privi di cellule normalmente deputate alla memoria (linfociti B, T e NK). Questi sono stati, poi, immunizzati con splenociti (cellule immunitarie isolate dalla milza) irradiati allogenici.
In seguito, i topi hanno subìto trapianto allogenico di midollo osseo ed è stata valutata la risposta indotta da monociti e macrofagi, in base all’infiltrazione del tessuto trapiantato. Lo studio ha evidenziato come i topi immunizzati e trapiantati con tessuto, proveniente dallo stesso topo da cui erano stati presi gli splenociti, innescassero una risposta immunitaria maggiore. Al contrario, i topi non immunizzati o immunizzati e trapiantati con tessuti provenienti da topi differenti rispetto a quelli da cui provenivano gli splenociti davano una risposta immunitaria minore (Figura 1). Questo risultato può essere ricondotto, secondo i ricercatori, solo ad una memoria immunologica, formatasi in seguito ad immunizzazione.
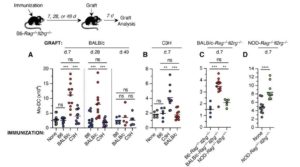
Figura 1
Il recettore PIR-A
Dopo aver individuato che la memoria immunologica si attiva in risposta a MHC-I non self, i ricercatori hanno voluto indagare le possibili molecole responsabili della formazione della memoria. Hanno, quindi, ricercato in un database contenente 17 genomi di topo, le potenziali molecole in grado di riconoscere e legare i complessi MHC-I.
Tra queste molecole, hanno suscitato grande interesse i recettori PIR (Paired Immunoglobulin-like receptor), ortologhi in uomo dei recettori LILR (Leukocyte Immunoglobulin-like Receptor). In particolare, tra questi, PIR-A sembra mediare la formazione della memoria immunologica. Questo è stato dimostrato in due modi:
- Bloccando il legame tra PIR-A e MHC-I mediante l’utilizzo di una proteina ingegnerizzata;
- Eliminando il gene codificante PIR-A (Figura 2).
In entrambi i modi, è stata bloccata l’infiltrazione di monociti e macrofagi nel tessuto trapiantato.
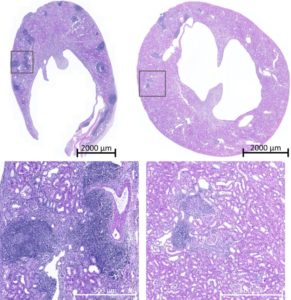
Figura 2
Prospettive future
Questo risultato potrebbe essere utile per sviluppare, in futuro, dei farmaci in grado di sopprimere la memoria immunologica delle cellule dell’immunità innata per prevenire un rigetto a lungo termine. Infatti, se, ormai, il rigetto acuto è diminuito in modo significativo grazie all’utilizzo di farmaci immunosoppressori, spesso questi non sono in grado di bloccare in maniera definitiva un rigetto cronico.
Non solo, questa scoperta potrebbe influenzare anche altri ambiti. Infatti, potrebbe portare ad una migliore comprensione di patologie come il cancro o le malattie autoimmuni.
Emanuela Pasculli
Fonti
- “Transplant Rejection May Be Prevented by Blocking Innate Immune Memory” (8 Maggio 2020). Estrapolato da
- https://www.genengnews.com/news/transplant-rejection-may-be-prevented-by-blocking-innate-immune-memory/;
- https://www.msdmanuals.com/it-it/professionale;
- Dai, Hehua, et al. “PIRs mediate innate myeloid cell memory to nonself MHC molecules.” Science (2020).